Ecco il supermicroscopio che studia la vita in 4D
Il laboratorio Clem di Humanitas integra raffinate tecnologie di microscopia ottica, elettronica e criogenica con l'Ia. Una “Tac delle cellule”, capace di “vedere” fino al milionesimo di millimetro

Quando, nel 1931, il fisico tedesco Ernst Ruska costruisce il primo microscopio elettronico, neanche il suo genio visionario arriva ad immaginare che quella intuizione (premiata con il Nobel per la Fisica nel 1986) aprirà di fatto la strada a visioni mozzafiato dell’infinitamente piccolo del nostro organismo. Non può immaginare di vedere, fino ad un nanometro, le superfici delle ali delle cicale o della pelle degli squali, scoprendo che hanno proprietà che le rendono inattaccabili dai batteri e quindi utilizzabili per le protesi; e che si può “guardare” la replicazione virale in tempo reale; oppure l’offensiva di un farmaco contro una infiammazione, o il meccanismo con il quale una cellula tumorale evade il sistema immunitario.
Ecco cosa possono osservare le lenti di obiettivi e oculari di una nuova piattaforma di imaging avanzata, appena inaugurata nel campus milanese di Humanitas University, a pochi passi dalle corsie dell’Irccs Istituto clinico Humanitas. Il laboratorio si chiama Clem (Correlative light-electron microscopy), è il primo in Italia (e tra i primi in Europa) disponibile in un ospedale di ricerca. Integra tecnologie di microscopia ottica, elettronica e criogenica all’elaborazione dei dati con l’Intelligenza artificiale. È capace di indagare tutte le scale di grandezza, dai tessuti fino alle strutture sub cellulari e molecolari, ottenendo immagini 3D ad alta definizione. Per dirla in soldoni, è una Tac cellulare, che scava a fondo, molto a fondo: perché vede fino al miliardesimo di metro o, se preferite, al milionesimo di millimetro, insomma in nanometri.

Alla base di questo investimento da 4,5 milioni di euro, come dice il responsabile del Clem, Edoardo D’Imprima, biochimico rientrato dall’European Molecular biology laboratory di Heidelberg (Germania), proprio come il suo collega Martin Centola, proveniente dal Max Planck Institute of Biophysics di Francoforte, «la consapevolezza che ciò che accade nel micro - a livello subcellulare all’interno di tessuti - ha effetti sul macro, sui sintomi della malattia». La Clem, specifica una nota di Humanitas, nasce dunque per unire due approcci complementari allo studio della biologia: la microscopia ottica a fluorescenza (novità premiata con il Nobel della Chimica del 2008), che permette di osservare eventi dinamici in tessuti vivi; e la microscopia elettronica, che offre una risoluzione nanometrica per analizzare la struttura delle componenti cellulari.
Quattro dimensioni per studiare la biologia
La microscopia elettronica tradizionale ottiene immagini in 2D mentre il Clem utilizza una tecnologia - detta “Volume Em” - che permette di osservare in 3 dimensioni a risoluzione nanometrica, alle quali va aggiunta una quarta, quella temporale. È come guardare una via cittadina passando dalla prospettiva di una mappa stradale - piatta e dall’alto - al punto di vista di un pedone che cammina in quella strada: una visione tridimensionale, e quindi iperdettagliata.
Un altro elemento chiave è l’introduzione delle tecniche di crio-microscopia (tecnica consacrata dal Nobel per la Chimica nel 2017), che si basano sul “congelamento” istantaneo dei campioni biologici tramite azoto liquido ad alta pressione, che evita la formazione in ghiaccio e ne preserva l’integrità strutturale. Grazie a questa combinazione, oggi è possibile osservare un evento biologico in diretta, localizzarlo con precisione e bloccarlo nel tempo per analizzarlo nei minimi dettagli e in 3D.
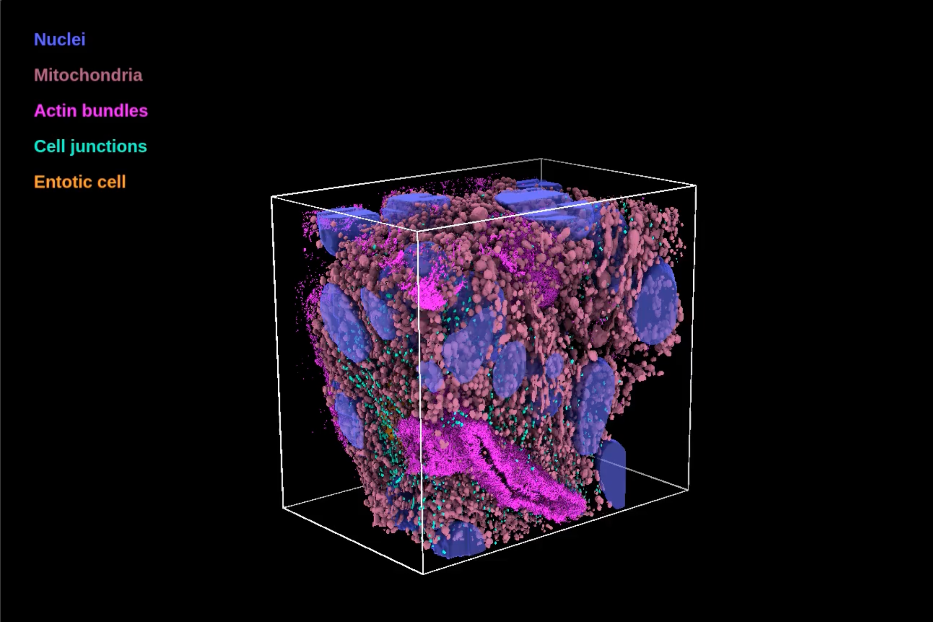
«La Clem è una nuova frontiera per la biologia e la medicina, perché consente di collegare funzione e struttura, macro e micro – osserva D’Imprima –. In un’epoca in cui la medicina di precisione richiede una comprensione sempre più profonda e dettagliata dei processi biologici, che sono altamente complessi, la Clem unisce “il film” della dinamica cellulare con l’istantanea del dettaglio molecolare delle strutture coinvolte. Una enorme mole di dati che, grazie all’Intelligenza artificiale e alla potenza di calcolo, può fornire ai medici non solo immagini ma una risposta quantitativa». Questa piattaforma, aggiunge il rettore di Humanitas University e direttore scientifico dell’Istituto Humanitas, Luigi Maria Terracciano, «insieme alle tecnologie ed expertise già presenti – come la proteomica, la metabolomica e la biologia computazionale – ci permetterà di esplorare in modo approfondito le strutture e i meccanismi biologici alla base delle malattie. Rappresenta dunque una risorsa trasversale per la ricerca d’avanguardia».
Le prime applicazioni: batteri, neuroscienze e microbiota
Tra i primi ricercatori ad avviare collaborazioni con il nuovo laboratorio, c’è Roberto Rusconi, professore associato di Humanitas University e responsabile del Laboratorio di Biofisica applicata, che studia come diverse tipologie di superfici possono cambiare l’adesione batterica e il rischio di infezione nelle protesi mediche, senza l’utilizzo di antibiotici. E poi Davide Pozzi, professore associato di Humanitas University, che, nell’ambito del programma di Neuroscienze diretto dalla professoressa Michela Matteoli, vuole utilizzare i nuovi microscopi per osservare se e come l’infiammazione è in grado di alterare la struttura delle sinapsi, i punti di connessione tra i neuroni che rappresentano un nodo cruciale all’origine delle malattie neurodegenerative.

La microbiologa Sara Carloni, ricercatrice del laboratorio diretto dalla professoressa Maria Rescigno, studia invece gli strumenti molecolari con cui i batteri del microbiota comunicano con l'ospite e tra loro, scambiandosi informazioni e capacità, tra cui la resistenza agli antibiotici. A dimostrazione che quello straordinario viaggio inaugurato nel 1931 da Ruska non è tutt’altro che concluso. Anzi, si arricchisce ora di un nuovo capitolo, potenzialmente epocale per la diagnostica e per nuove cure.
© RIPRODUZIONE RISERVATA







